上海聚顶生物科技有限公司
3 年
手机商铺
- NaN
- 0
- 0
- 1
- 0
公司新闻/正文
KEL Biotech™ 流式抗体TRBC1的应用
57 人阅读发布时间:2026-01-13 14:34
TRBC1在成熟T细胞淋巴瘤中的表达特点及诊断价值
TRBC1是T细胞受体β链恒定区1(TCellReceptorBetaConstant1)的缩写,与免疫系统中T细胞的功能密切相关,以下是关于它的详细介绍:
TRBC1的基本概念
所属家族:属于T细胞受体(TCellReceptor,TCR)β链基因家族的一部分。TCR是T细胞表面的特异性受体,负责识别抗原呈递细胞(APC)呈递的抗原肽-MHC复合物,从而启动免疫反应。
基因定位:人类TRBC1基因位于染色体7q35区域,与TRBC2基因相邻,二者共同参与TCRβ链恒定区的编码。
结构与功能:TRBC1编码TCRβ链的恒定区,该区域不直接参与抗原识别,而是在TCR与抗原结合后,通过与CD3复合体相互作用,传递细胞活化信号,促使T细胞增殖、分化并发挥免疫效应。
TCR的组成与TRBC1的作用
TCR的结构:TCR通常由α和β链(或γ和δ链)组成,每条链包含可变区(V区)和恒定区(C区)。
可变区:由V、D、J基因片段重排形成,决定抗原识别的特异性。
恒定区:由TRBC1或TRBC2等基因编码,连接可变区与CD3复合体,介导信号传导。
TRBC1与TRBC2的差异:
二者编码的恒定区氨基酸序列略有不同,但功能相似,均参与TCR-β链的组装和信号传递。
在T细胞发育过程中,TRBC1和TRBC2的表达可能受不同调控机制影响,但最终均能形成功能性TCR。
TRBC1与免疫相关疾病的联系
T细胞发育异常:TRBC1基因的突变或表达异常可能影响T细胞的成熟和分化,导致免疫功能缺陷或自身免疫性疾病。
疾病研究靶点:在某些免疫相关疾病(如自身免疫性关节炎、多发性硬化症等)中,T细胞的异常活化与TRBC1参与的信号通路相关,因此TRBC1可能成为潜在的研究靶点。
研究意义与应用
免疫学基础研究:通过研究TRBC1的结构和功能,有助于深入理解T细胞活化的分子机制及免疫系统的调控原理。
临床应用前景:在免疫治疗领域,针对TRBC1相关信号通路的干预可能成为调节T细胞功能的新策略,例如在肿瘤免疫治疗中增强T细胞的杀伤活性。
总结
TRBC1作为TCR-β链恒定区的编码基因,在T细胞介导的免疫反应中扮演关键角色,其功能与T细胞的活化、信号传导及免疫应答密切相关。对TRBC1的深入研究有助于揭示免疫系统的工作机制,并为免疫相关疾病的诊断和治疗提供新的思路。
T细胞受体恒定β链重排概述
TCR和Ig受体是抗原结合受体,对适应性免疫至关重要,因为它们能识别和结合多种病原体。这是通过一个称为体细胞重组的过程实现的,体细胞重组发生在细胞个体发育过程中,涉及编码TCR和Ig受体的种系基因的重排。因此,每个T细胞和B细胞表达一种独特的TCR或Ig受体。如果由于良性免疫反应或恶性免疫反应而被激活或自身免疫变化,细胞可能发生克隆扩增。每个子细胞将携带一个相同的TCR/Ig受体,这个指纹可以用来诊断克隆的存在。
TCR是一种跨膜蛋白,由两条二硫连接的多肽链组成:α链和β链,或者在约5-15%的T细胞中,有γ链和δ链。每个多肽链由一个变量区和一个恒定(C)区组成。可变区包含抗原结合表位,使每个细胞(或克隆)具有独特的受体结构。T细胞克隆的存在可以通过PCR检测,使用针对不同V、D和J段设计的引物,从而扩增出跨越这些独特序列的产物。理论上,任何TCR链(α, β, γ或δ)都可以用作模板。然而,在实践中,TCRγ和TCRβ链是靶向的。这是由于TCR基因重排在T细胞个体发生过程中的组织方式:TCRδ位点首先重排,其次是TCRγ位点。这将产生功能性γδTCR蛋白,或者随后发生TCRβ基因座重排、TCRδ基因座缺失和TCRα基因座重排。反过来,这可能导致αβTCR蛋白的功能。TCRγ重排位点在几乎所有T细胞中都有保留,包括αβTCR+T细胞,其基因结构比α或βTCR位点更简单。因此,TCRγ位点主要用于T细胞克隆性评估。此外,TCRβ也用于这一目的,并且优于α基因座,因为α基因座中的V和J片段数量要多得多:与β基因座中的64V和14J片段相比,至少有70V和61J片段。
相比之下,TCR的C区不是识别抗原的直接结构的一部分。C区基因座编码TCR链的胞外恒定结构域、连接肽、跨膜结构域和最小胞内结构域。α链和γ链各有1个C区基因片段;β链和δ链各有C1和C2两个片段。因此,任何给定的T细胞上的αβTCR将具有含有C1或C2的β链。由于经过克隆扩增的t细胞衍生的所有子细胞将携带相同的TCR,因此用TCRβC1或TCRβC2特异性抗体标记克隆群体将导致阳性或阴性信号(图1),这与用于B细胞分析的kappa/lambda标记方法没有什么不同。据我们所知,只有一种市售抗体具有已知的TCRβ C区域(也简称为TRBC)特异性:TRBC1结合单克隆抗体JOVI.1。
JOVI.1 (抗TRBC1)抗体的研制与鉴定
市场上可获得的抗人TRBC1抗体产生杂交瘤是由Viney等人在近30年前创造的[1],当时他们希望产生针对人TCR不同Vβ区域的特异性单克隆抗体。TCR可变区免疫原性较差,因此,他们没有使用人细胞或纯化的TCRβ链蛋白作为免疫原,而是使用转染了由鼠α链和人β链组成的TCR结构的小鼠细胞系作为免疫原,该结构由Vβ3、Dβ1、Jβ1.2和Cβ1组成。其中一个被命名为JOVI.1的杂交瘤产生了一种IgG2a抗体,该抗体当时被认为与大多数TCR上的“决定因素”结合。然而,这些早期研究并没有得出TRBC1特异性的清晰图像。例如,用杂交瘤培养上清和山羊抗小鼠FITC抗体标记的外周血或T细胞系流式细胞术分析显示,CD4+T细胞从阴性到阳性不等,CD8+T细胞标记为双相阳性或阴性。已知TRBC1阳性细胞系与抗体反应;然而,一些TRBC2表达细胞系也表现出反应性,尽管较弱。由于其T细胞有丝分裂特性或免疫沉淀,后续研究通常使用该抗体。Maciocia等人最终于2017年发表了纯化抗体对TRBC1特异性的证据。该小组寻找TCRβ恒定区特异性抗体,目的是创建仅针对TRBC1或TRBC2表达的CAR-T细胞,这种策略可能允许T细胞定向CAR-T细胞治疗,而不会完全耗尽患者的T细胞区和适应性免疫。已知两个β链C片段的序列和基因组组织非常相似,这可能增加了高度特异性mab的开发难度。因此,Maciocia等人使用市售的JOVI.1抗体对表达多种克隆TCR构建体的细胞系进行了广泛的研究。这证实了没有标记TCR恒定区2,而且,JOVI.1与恒定区1的结合不依赖于任何特定的TCRβ连接段。
KEL Biotech™ 实验数据:
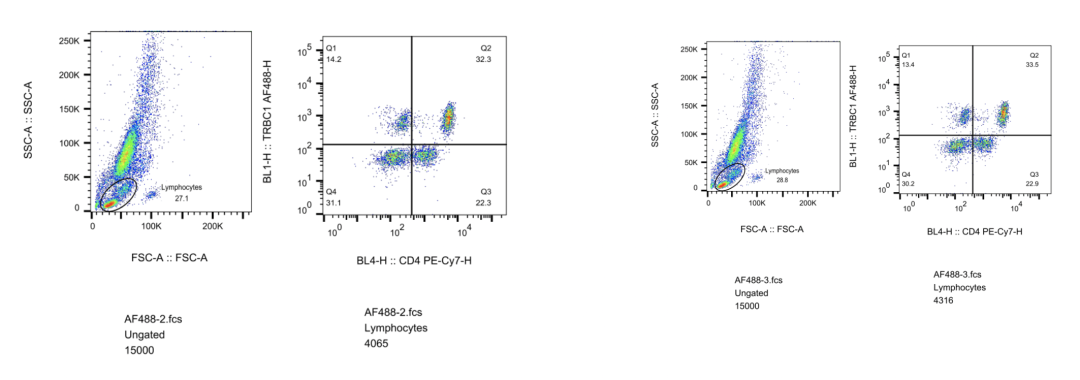
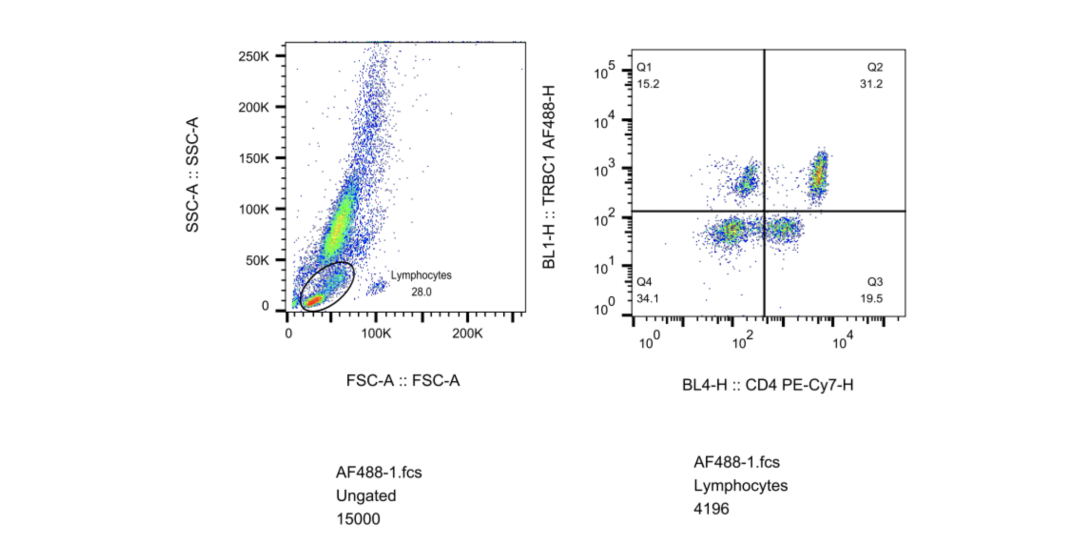
T细胞白血病和淋巴瘤,统称为T细胞癌,在全世界范围内,每年新增约100000名患者。成年的复发性T细胞癌患者的5年生存率为7%-38%,他们的治疗选择有限。相比之下,B细胞癌患者有一系列靶向泛B细胞抗原的新型抗体药物和CAR-T细胞疗法,从而提高了生存率。但开发针对T细胞癌的类似治疗方法却一直具有挑战性。
正常和肿瘤性T细胞或B细胞的细胞表面表达类似的抗原,靶向泛B细胞抗原是可行的,因为治疗导致的正常B细胞再生障碍被良好耐受。然而,靶向泛T细胞抗原是不可行的,因为这会导致严重的免疫抑制。因此,T细胞癌的治疗需要更特异性地靶向癌变T细胞。
临床前研究表明,靶向T细胞受体β-链恒定区1(TRBC1)可以杀死癌变T细胞,同时保留足够的健康T细胞来维持免疫功能,这使得TRBC1成为治疗T细胞癌的有潜力的靶点。然而,首次在人类中进行的抗TRBC1 CAR-T细胞疗法临床试验报告了低反应率和CAR-T细胞的不明原因丢失。
2024年3月27日,约翰-霍普金斯大学医学院 Suman Paul 团队在 Nature 期刊发表了题为:TRBC1-targeting antibody–drug conjugates for the treatment of T cell cancers 的研究论文【1】。
该研究证实了抗TRBC1 CAR-T细胞由于被患者正常的TRBC1+ T细胞杀死而丢失,从而导致治疗反应不佳。为了解决这个问题,研究团队开发了一种靶向TRBC1的ADC药物,可以在体外杀死TRBC1+癌细胞,并在小鼠模型中治愈了人类T细胞癌。靶向TRBC1的ADC药物可能为TRBC1靶向提供最佳形式,并在T细胞癌患者中产生优异应答。
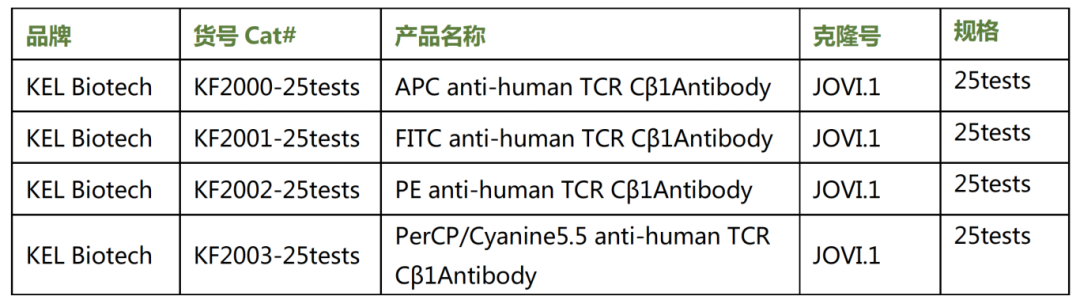
KEL Biotech聚顶生物有多种荧光素的TRBC1(JOVI.1)的品类可以供各位临床老师选择:
注意:如需详细配色方案,请来电咨询or店内咨询






